| Introduction | Structures planétaires | Observables | Techniques et méthodes | Lieux de vie | Auteurs | Boite à outils |
Structure Atomique de l'hydrogène |
L'atome est le constituant de base de la matière; il est formé d'un noyau chargé positivement et d'un nuage d'électrons chargé négativement. Le noyau contient A nucléons, dont Z protons chargé positivement et (A-Z) neutrons de charge nulle. Un atome est électriquement neutre et contient donc Z protons et Z électrons. Des atomes ayant un nombre Z identique mais un nombre A différent sont appelés isotopes. Par exemple, l'atome de deutérium composé de 1 proton, 1 neutron et 1 électron (Z=1, A=2) est un isotope de l'hydrogène composé de 1 proton et 1 électron (Z=1, A=1). La science qui étudie la structure interne des atomes s'appelle l'atomistique.
La dispersion de la lumière par un gaz atomique présente une structure sous forme de raies. Chaque élément a un spectre de raies caractéristiques, par exemple l'hydrogène et le deutérium possèdent plusieurs séries de raies portant le nom des scientifiques qui les ont observées pour la première fois. La série des raies de Lyman dans l'ultraviolet a été observée pour la première fois par Théodore Lyman en 1906. Johann Balmer a découvert quatre raies de la série de Balmer en 1885 dans le visible.
Johannes Rydberg et Walter Ritz montrèrent que les longueurs d'onde des différentes séries pouvaient être décrites par la formule de Rydberg-Ritz:
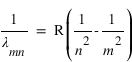 R est la constante de Rydberg, m et n sont deux nombres entiers. La structure en raies des spectres d'émission des atomes et la présence de nombre entiers dans l'équation de Rydberg suggère une quantification de l'énergie des électrons dans le nuage atomique, on parle de niveaux d'énergie. Les valeurs de l'énergie sont quantifiées par un nombre entier n et données par
R est la constante de Rydberg, m et n sont deux nombres entiers. La structure en raies des spectres d'émission des atomes et la présence de nombre entiers dans l'équation de Rydberg suggère une quantification de l'énergie des électrons dans le nuage atomique, on parle de niveaux d'énergie. Les valeurs de l'énergie sont quantifiées par un nombre entier n et données par
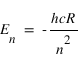 ou h est la constante de Planck et c la vitesse de la lumière dans le vide. Une raie d'émission résulte d'une transition d'un électron du niveau m vers le niveau n (m>n).
Cette quantification de l'énergie d'un atome ne peut s'expliquer par la physique classique. Bohr présentera un premier modèle théorique permettant de démontrer la formule de Rydberg-Ritz en 1913, mais c'est la physique quantique développée dans les années 1920 par Schrodinger et Heisenberg, puis la théorie des champs développée par Dirac qui permettront non seulement de retrouver la formule de Rydberg-Ritz mais aussi d'expliquer toutes les observations de la structure de l'hydrogène.
L'étude des émissions spectroscopiques est à la base de l'astrophysique.
ou h est la constante de Planck et c la vitesse de la lumière dans le vide. Une raie d'émission résulte d'une transition d'un électron du niveau m vers le niveau n (m>n).
Cette quantification de l'énergie d'un atome ne peut s'expliquer par la physique classique. Bohr présentera un premier modèle théorique permettant de démontrer la formule de Rydberg-Ritz en 1913, mais c'est la physique quantique développée dans les années 1920 par Schrodinger et Heisenberg, puis la théorie des champs développée par Dirac qui permettront non seulement de retrouver la formule de Rydberg-Ritz mais aussi d'expliquer toutes les observations de la structure de l'hydrogène.
L'étude des émissions spectroscopiques est à la base de l'astrophysique.