| Introduction | Structures planétaires | Observables | Techniques et méthodes | Lieux de vie | Auteurs | Boite à outils |
La chromosphère |
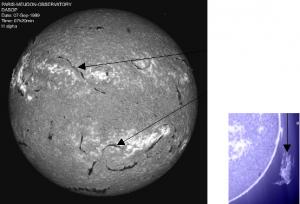
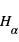 de l'hydrogène. A gauche : Les taches blanches correspondent à des région en émission alors que les structures filamentaires en noire correspondent à l'absorption. Les structures noires sont des filaments, l'équivalent des protubérance que l'on observe au limbe solaire vue sur l'image de droite).
de l'hydrogène. A gauche : Les taches blanches correspondent à des région en émission alors que les structures filamentaires en noire correspondent à l'absorption. Les structures noires sont des filaments, l'équivalent des protubérance que l'on observe au limbe solaire vue sur l'image de droite).
La chromosphère est une région d'environ 1000 km au dessus de la photopshère où la densité décroit mais la température augmente de 4200K à environ 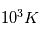 . Alors que la chute en densité avec l'altitude est attendue pour une atmosphère, l'augmentation de la température est toujours un domaine de recherche actif. La chromosphère étant plus ténue que la photosphère, l'approximation du corps noir n'est plus valide, c'est alors les interactions photon-matière qui dominent l'émission.
. Alors que la chute en densité avec l'altitude est attendue pour une atmosphère, l'augmentation de la température est toujours un domaine de recherche actif. La chromosphère étant plus ténue que la photosphère, l'approximation du corps noir n'est plus valide, c'est alors les interactions photon-matière qui dominent l'émission.
En l'absence d'éruption, cette couche atmosphérique est observée principalement à 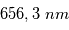 qui correspond à la raie
qui correspond à la raie 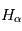 de l'hydrogène. Pour déterminer les longueurs d'ondes des raies atomiques de l'hydrogène, on utilise le modèle atomique de Bohr. Un atome d'hydrogène est composé d'un électron en orbite autour du noyau. Cet électron peut se trouver sur différentes orbites en fonction de l'énergie du système. L'un des postulats de Bohr est la quantification du moment cinétique, et donc que l'énergie totale de l'électron sur une orbite donnée est aussi quantifiée. On peut en effet montrer que l'énergie totale d'un électron est :
de l'hydrogène. Pour déterminer les longueurs d'ondes des raies atomiques de l'hydrogène, on utilise le modèle atomique de Bohr. Un atome d'hydrogène est composé d'un électron en orbite autour du noyau. Cet électron peut se trouver sur différentes orbites en fonction de l'énergie du système. L'un des postulats de Bohr est la quantification du moment cinétique, et donc que l'énergie totale de l'électron sur une orbite donnée est aussi quantifiée. On peut en effet montrer que l'énergie totale d'un électron est :
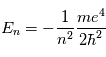
où n = 1, 2, 3,... est le niveau d'énergie et 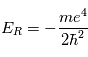 est l'énergie de Rydberg et correspond à l'état d'énergie le plus bas pour n=1. Pour déterminer l'énergie du photon émis/absorbé pour passer d'un niveau
est l'énergie de Rydberg et correspond à l'état d'énergie le plus bas pour n=1. Pour déterminer l'énergie du photon émis/absorbé pour passer d'un niveau 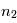 à
à 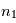 , il suffit de calculer la différence d'énergie entre les 2 niveaux :
, il suffit de calculer la différence d'énergie entre les 2 niveaux : 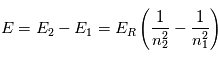
Lorsque l'électron absorbe ou rayonne un photon, il acquiert ou perd respectivement de l'énergie. La quantité d'énergie correspondant à l'aborption ou à l'émission d'un photon est : 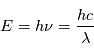
où 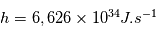 est la constante de Planck,
est la constante de Planck, 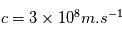 est la vitesse de la lumière,
est la vitesse de la lumière, 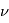 et
et 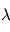 sont respectivement la fréquence et la longueur d'onde du photon émis ou absorbé. En égalisant les 2 expressions définissant l'énergie d'un photon, on obtient une expression pour déterminer la longueur d'onde du photon émis :
sont respectivement la fréquence et la longueur d'onde du photon émis ou absorbé. En égalisant les 2 expressions définissant l'énergie d'un photon, on obtient une expression pour déterminer la longueur d'onde du photon émis : 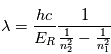
En plus de la chromosphère, d'autres structures contenant du plasma similaire au plasma chromosphérique sont observables à plus haute altitude en 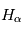 . C'est le cas par exemple des protubérances solaires. Ces structures seront présentées plus en détails dans la partie activité solaire.
. C'est le cas par exemple des protubérances solaires. Ces structures seront présentées plus en détails dans la partie activité solaire.
La série de Balmer définie les raies d'émission de l'atome d'hydrogène correspondant aux transitions entre le sniveaux n=2 et n=5. Déterminez le différentes longueurs asssociées aux différentes transitions.