Certains noyaux atomiques, appelés radioisotopes, sont naturellement instables et peuvent spontanément se désintégrer en noyaux moins massifs et stables, libérant de l’énergie sous forme de rayonnement. La décroissance du nombre 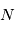 d’un type de radioisotopes
d’un type de radioisotopes 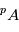 en un élément
en un élément 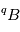 suit une décroissance exponentielle
suit une décroissance exponentielle 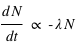 . Où la quantité
. Où la quantité 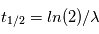 est le temps de demi-vie caractéristique de l’élément. Dans le cas le plus simple où aucun élément
est le temps de demi-vie caractéristique de l’élément. Dans le cas le plus simple où aucun élément 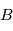 n’est présent initialement le temps t peut être trouvé directement par le rapport
n’est présent initialement le temps t peut être trouvé directement par le rapport 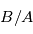 . Mais en réalité les choses ne sont jamais aussi simples, et ce pour au moins 2 raisons :
. Mais en réalité les choses ne sont jamais aussi simples, et ce pour au moins 2 raisons :
1) Il y a a priori toujours du 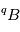 présent à
présent à 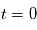 ou, du moins, il est impossible d’exclure cette présence. Et on ne connait pas a priori cette quantité initiale de
ou, du moins, il est impossible d’exclure cette présence. Et on ne connait pas a priori cette quantité initiale de 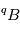
2) l’isotope 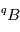 n’est souvent pas le seul possible pour l’élément
n’est souvent pas le seul possible pour l’élément 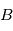 , qui peut également exister sous la forme
, qui peut également exister sous la forme 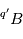 , ce qui peut fortement compliquer les choses. En effet, dans un matériau à l'état gazeux ou liquide, les isotopes
, ce qui peut fortement compliquer les choses. En effet, dans un matériau à l'état gazeux ou liquide, les isotopes 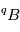 et
et 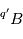 vont naturellement s'équilibrer entre eux à une valeur d'équilibre. En conséquence, dès qu'un matériau fond ou fusionne, toute information sur la quantité d'isotope
vont naturellement s'équilibrer entre eux à une valeur d'équilibre. En conséquence, dès qu'un matériau fond ou fusionne, toute information sur la quantité d'isotope 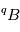 produite par désintégration de
produite par désintégration de 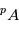 va être perdue par cette mise à l'équilibre isotopique (autrement dit, toute fusion est un "reset" des isotopes de B).
va être perdue par cette mise à l'équilibre isotopique (autrement dit, toute fusion est un "reset" des isotopes de B).
Ceci va rendre la datation plus compliquée, mais elle reste néanmoins possible, du moins pour remonter jusqu'au moment de la dernière condensation du matériau. On peut grosso-modo distinguer 2 types de datation : datation absolue et datation relative.
La désintégration de 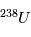 en
en 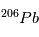 a un temps de ½ vie de 4.47 109 ans, idéal pour mesurer l’âge des plus anciens corps du système solaire. Mais
a un temps de ½ vie de 4.47 109 ans, idéal pour mesurer l’âge des plus anciens corps du système solaire. Mais 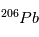 n’est pas l’isotope naturel du
n’est pas l’isotope naturel du 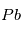 , qui est
, qui est 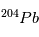 . On obtient alors la relation suivante, liant les abondances de
. On obtient alors la relation suivante, liant les abondances de 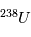 ,
, 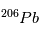 et
et 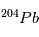 :
:
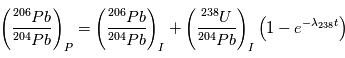
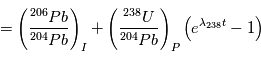
où les indices 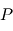 et
et 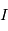 se réfèrent aux abondances actuelles et initiales, respectivement. Le moment "initial" correspond à l'instant où l'objet en question s'est solidifié pour la dernière fois. En effet, dès que le corps fond ou se sublime en gaz, les proportions des 2 isotopes
se réfèrent aux abondances actuelles et initiales, respectivement. Le moment "initial" correspond à l'instant où l'objet en question s'est solidifié pour la dernière fois. En effet, dès que le corps fond ou se sublime en gaz, les proportions des 2 isotopes 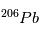 et
et 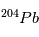 s'équilibrent rapidement à leur proportion "naturelle" et toute information sur la désintégration de
s'équilibrent rapidement à leur proportion "naturelle" et toute information sur la désintégration de 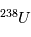 est perdue (voir page précédente ). A cet instant initial le rapport
est perdue (voir page précédente ). A cet instant initial le rapport 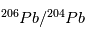 est donc égal à la valeur d'équilibre. En revanche, une fois le corps solidifié, un excès de l'isotope
est donc égal à la valeur d'équilibre. En revanche, une fois le corps solidifié, un excès de l'isotope 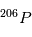 va petit à petit se créer à mesure que
va petit à petit se créer à mesure que 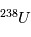 se désintègre. La variable inconnue est ici la quantité initiale absolue de
se désintègre. La variable inconnue est ici la quantité initiale absolue de 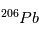 (ou de
(ou de 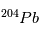 ), que l'on ne connaît pas a priori. Heureusement, il existe un deuxième type de désintégration d’U en Pb, la réaction
), que l'on ne connaît pas a priori. Heureusement, il existe un deuxième type de désintégration d’U en Pb, la réaction 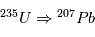 , dont le temps de vie est de 704 106 ans, et qui va nous permettre de contraindre les abondances initiales. Les équations sont alors:
, dont le temps de vie est de 704 106 ans, et qui va nous permettre de contraindre les abondances initiales. Les équations sont alors:
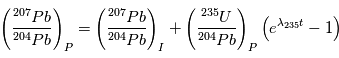
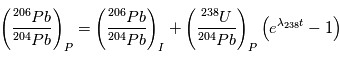
Et donc:
![F = \left [\frac{\left (\frac{{}^{207}Pb}{{}^{204}Pb} \right )_P -\left (\frac{{}^{207}Pb}{{}^{204}Pb} \right )_I }{ \left (\frac{{}^{206}Pb}{{}^{204}Pb} \right )_P - \left (\frac{{}^{206}Pb}{{}^{204}Pb} \right )_I} \right ]=\left ( \frac{1}{137.88} \right )\left ( \frac{e^{\lambda {}_{235}t} -1}{e^{\lambda {}_{238}t} -1} \right )](../pages_mecanique-formation/equations_datation-radio-isotopique/equation41.png)
où 137.88 est la valeur présente de 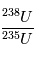 , qui est une constante globale du système solaire actuel, et
, qui est une constante globale du système solaire actuel, et 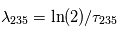 ,
, 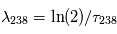 . Cette relation est directement exploitable pour toute météorite non-homogène initialement, mais dont tous les composants se sont formés à la même époque. En effet, dans ce cas, les rapports initiaux
. Cette relation est directement exploitable pour toute météorite non-homogène initialement, mais dont tous les composants se sont formés à la même époque. En effet, dans ce cas, les rapports initiaux 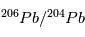 et
et 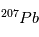 /
/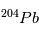 sont les mêmes partout dans la météorite et sont égaux à leurs valeurs d'équilibre (indiquées par a0 et b0 sur la figure). Par conséquent, dans un graphe
sont les mêmes partout dans la météorite et sont égaux à leurs valeurs d'équilibre (indiquées par a0 et b0 sur la figure). Par conséquent, dans un graphe 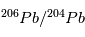 vs.
vs. 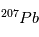 /
/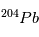 , toutes les mesures du rapport F doivent se situer une même droite, appelée isochrone, dont la pente va directement donner l’âge de la météorite (cf. Figure).
, toutes les mesures du rapport F doivent se situer une même droite, appelée isochrone, dont la pente va directement donner l’âge de la météorite (cf. Figure).
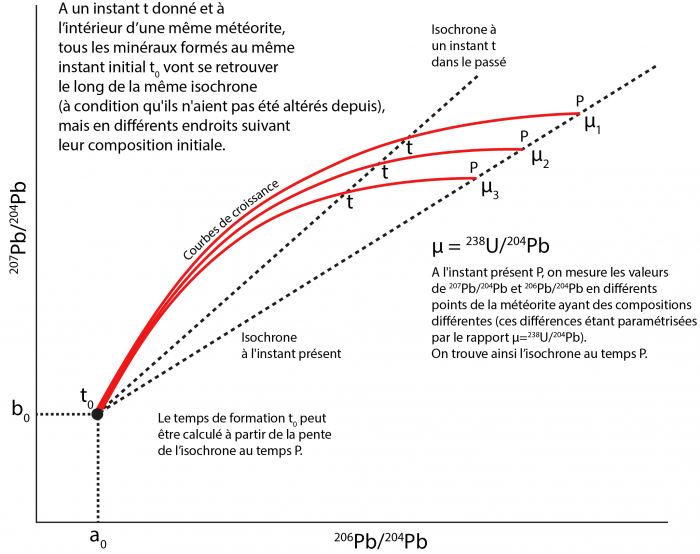
Isochrone isotopique construite à partir des abondances actuelles relatives de 207Pb, 206Pb et 204Pb en différents endroits d’une même météorite
Crédit :
Observatoire de Paris
La désintégration radioactive permet également de dater des corps même bien après la disparition des radionucléotides concernés (c'est à dire bien au delà du temps de 1/2-vie de la désintégration concernée). C’est le cas par exemple de la désintégration 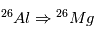 , dont le temps de ½ vie est de « seulement » 720 000ans. Notons que ni
, dont le temps de ½ vie est de « seulement » 720 000ans. Notons que ni 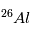 , ni
, ni 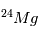 ne sont des isotopes naturels de leurs éléments, qui sont, respectivement,
ne sont des isotopes naturels de leurs éléments, qui sont, respectivement, 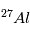 et
et 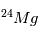 . A la différence de la désintégration d’
. A la différence de la désintégration d’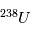 , il n’existe aujourd’hui plus de
, il n’existe aujourd’hui plus de 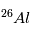 que l’on puisse mesurer. En principe, on a donc :
que l’on puisse mesurer. En principe, on a donc :
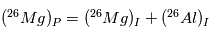
Cette équation n’est pas d’une grande aide en elle-même, mais, comme pour la datation absolue, on peut tirer parti de la non-homogénéité d’une météorite donnée. Si en effet deux endroits de cette météorite avaient initialement des teneurs totales en 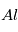 (tous isotopes confondus) différentes, mais que la proportion de
(tous isotopes confondus) différentes, mais que la proportion de 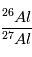 était, elle, la même, alors l’excès de
était, elle, la même, alors l’excès de 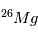 ne sera aujourd’hui pas partout le même, et cet excès sera relié à l’abondance actuelle locale de
ne sera aujourd’hui pas partout le même, et cet excès sera relié à l’abondance actuelle locale de 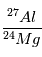 par la relation :
par la relation :
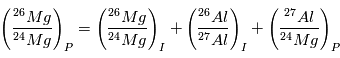
Les mesures de 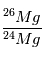 et
et 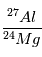 en différents endroits de la météorite
vont alors tracer une isochrone dont la pente donnera la teneur initiale en
en différents endroits de la météorite
vont alors tracer une isochrone dont la pente donnera la teneur initiale en
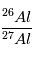 (voir Figure).
(voir Figure).
Maintenant, si on compare les teneurs initiales de 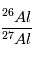 obtenus pour
différentes météorites, on peut obtenir une datation relative des temps de
formation de ces météorites. En effet, étant donné le temps de vie très court
de
obtenus pour
différentes météorites, on peut obtenir une datation relative des temps de
formation de ces météorites. En effet, étant donné le temps de vie très court
de 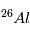 , sa teneur par rapport à
, sa teneur par rapport à 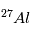 pourra être très différente suivant l’instant
où la météorite s’est formée. Si on compare les valeurs
pourra être très différente suivant l’instant
où la météorite s’est formée. Si on compare les valeurs 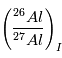 dans 2
météorites différentes, on obtient ainsi la datation relative de leur formation
par la formule:
dans 2
météorites différentes, on obtient ainsi la datation relative de leur formation
par la formule:
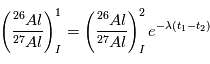
où 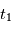 et
et 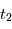 sont les instants de formation des 2 météorites, et
sont les instants de formation des 2 météorites, et 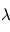 est le taux de
désintégration de la réaction
est le taux de
désintégration de la réaction 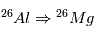
Il faut cependant ici bien faire attention à deux points très importants :
- ces mesures relatives ne sont possibles que si
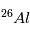 était uniformément
distribué dans la nébuleuse initiale. Les dernières recherches semblent cependant montrer que tel était bien le cas.
était uniformément
distribué dans la nébuleuse initiale. Les dernières recherches semblent cependant montrer que tel était bien le cas. - la fraction de
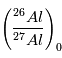 estimée correspond à ce qu’elle était au moment
de la dernière condensation de l’objet. En effet, quand le corps est dans un
état fluide (gaz, liquide), les abondances de
estimée correspond à ce qu’elle était au moment
de la dernière condensation de l’objet. En effet, quand le corps est dans un
état fluide (gaz, liquide), les abondances de 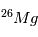 et
et 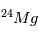 se ré-équilibrent
automatiquement à leurs proportions « naturelles » et tout excès antérieur
de
se ré-équilibrent
automatiquement à leurs proportions « naturelles » et tout excès antérieur
de 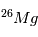 est effacé. Autrement dit, le chronomètre isotopique se « reset » lors
de tout épisode de très forte température.
est effacé. Autrement dit, le chronomètre isotopique se « reset » lors
de tout épisode de très forte température.
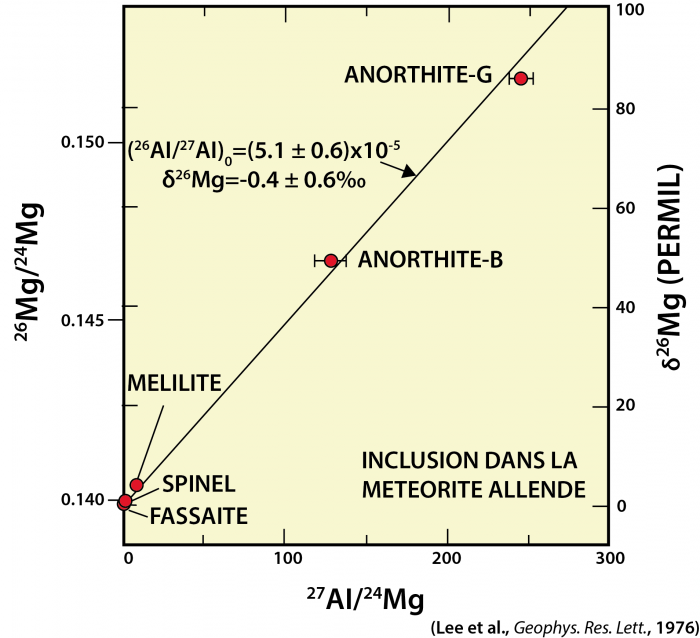
Isochrone obtenue à partir des abondances actuelles des différents isotopes de Mg et Al dans la météorite carbonée « Alliende »
Crédit :
Observatoire de Paris
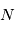 d’un type de radioisotopes
d’un type de radioisotopes 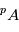 en un élément
en un élément 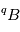 suit une décroissance exponentielle
suit une décroissance exponentielle 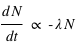 . Où la quantité
. Où la quantité 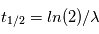 est le temps de demi-vie caractéristique de l’élément. Dans le cas le plus simple où aucun élément
est le temps de demi-vie caractéristique de l’élément. Dans le cas le plus simple où aucun élément 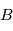 n’est présent initialement le temps t peut être trouvé directement par le rapport
n’est présent initialement le temps t peut être trouvé directement par le rapport 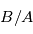 . Mais en réalité les choses ne sont jamais aussi simples, et ce pour au moins 2 raisons :
. Mais en réalité les choses ne sont jamais aussi simples, et ce pour au moins 2 raisons :
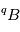 présent à
présent à 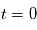 ou, du moins, il est impossible d’exclure cette présence. Et on ne connait pas a priori cette quantité initiale de
ou, du moins, il est impossible d’exclure cette présence. Et on ne connait pas a priori cette quantité initiale de 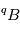
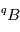 n’est souvent pas le seul possible pour l’élément
n’est souvent pas le seul possible pour l’élément 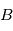 , qui peut également exister sous la forme
, qui peut également exister sous la forme 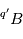 , ce qui peut fortement compliquer les choses. En effet, dans un matériau à l'état gazeux ou liquide, les isotopes
, ce qui peut fortement compliquer les choses. En effet, dans un matériau à l'état gazeux ou liquide, les isotopes 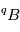 et
et 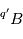 vont naturellement s'équilibrer entre eux à une valeur d'équilibre. En conséquence, dès qu'un matériau fond ou fusionne, toute information sur la quantité d'isotope
vont naturellement s'équilibrer entre eux à une valeur d'équilibre. En conséquence, dès qu'un matériau fond ou fusionne, toute information sur la quantité d'isotope 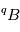 produite par désintégration de
produite par désintégration de 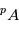 va être perdue par cette mise à l'équilibre isotopique (autrement dit, toute fusion est un "reset" des isotopes de B).
va être perdue par cette mise à l'équilibre isotopique (autrement dit, toute fusion est un "reset" des isotopes de B).
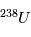 en
en 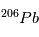 a un temps de ½ vie de 4.47 109 ans, idéal pour mesurer l’âge des plus anciens corps du système solaire. Mais
a un temps de ½ vie de 4.47 109 ans, idéal pour mesurer l’âge des plus anciens corps du système solaire. Mais 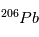 n’est pas l’isotope naturel du
n’est pas l’isotope naturel du 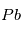 , qui est
, qui est 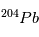 . On obtient alors la relation suivante, liant les abondances de
. On obtient alors la relation suivante, liant les abondances de 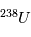 ,
, 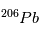 et
et 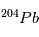 :
:
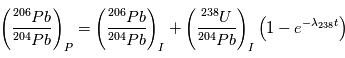
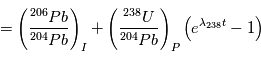
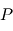 et
et 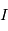 se réfèrent aux abondances actuelles et initiales, respectivement. Le moment "initial" correspond à l'instant où l'objet en question s'est solidifié pour la dernière fois. En effet, dès que le corps fond ou se sublime en gaz, les proportions des 2 isotopes
se réfèrent aux abondances actuelles et initiales, respectivement. Le moment "initial" correspond à l'instant où l'objet en question s'est solidifié pour la dernière fois. En effet, dès que le corps fond ou se sublime en gaz, les proportions des 2 isotopes 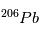 et
et 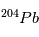 s'équilibrent rapidement à leur proportion "naturelle" et toute information sur la désintégration de
s'équilibrent rapidement à leur proportion "naturelle" et toute information sur la désintégration de 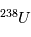 est perdue (voir
est perdue (voir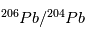 est donc égal à la valeur d'équilibre. En revanche, une fois le corps solidifié, un excès de l'isotope
est donc égal à la valeur d'équilibre. En revanche, une fois le corps solidifié, un excès de l'isotope 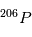 va petit à petit se créer à mesure que
va petit à petit se créer à mesure que 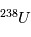 se désintègre. La variable inconnue est ici la quantité initiale absolue de
se désintègre. La variable inconnue est ici la quantité initiale absolue de 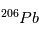 (ou de
(ou de 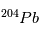 ), que l'on ne connaît pas a priori. Heureusement, il existe un deuxième type de désintégration d’U en Pb, la réaction
), que l'on ne connaît pas a priori. Heureusement, il existe un deuxième type de désintégration d’U en Pb, la réaction 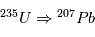 , dont le temps de vie est de 704 106 ans, et qui va nous permettre de contraindre les abondances initiales. Les équations sont alors:
, dont le temps de vie est de 704 106 ans, et qui va nous permettre de contraindre les abondances initiales. Les équations sont alors:
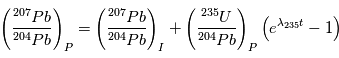
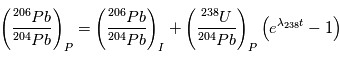
![F = \left [\frac{\left (\frac{{}^{207}Pb}{{}^{204}Pb} \right )_P -\left (\frac{{}^{207}Pb}{{}^{204}Pb} \right )_I }{ \left (\frac{{}^{206}Pb}{{}^{204}Pb} \right )_P - \left (\frac{{}^{206}Pb}{{}^{204}Pb} \right )_I} \right ]=\left ( \frac{1}{137.88} \right )\left ( \frac{e^{\lambda {}_{235}t} -1}{e^{\lambda {}_{238}t} -1} \right )](../pages_mecanique-formation/equations_datation-radio-isotopique/equation41.png)
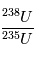 , qui est une constante globale du système solaire actuel, et
, qui est une constante globale du système solaire actuel, et 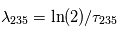 ,
, 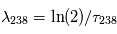 . Cette relation est directement exploitable pour toute météorite non-homogène initialement, mais dont tous les composants se sont formés à la même époque. En effet, dans ce cas, les rapports initiaux
. Cette relation est directement exploitable pour toute météorite non-homogène initialement, mais dont tous les composants se sont formés à la même époque. En effet, dans ce cas, les rapports initiaux 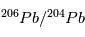 et
et 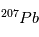 /
/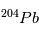 sont les mêmes partout dans la météorite et sont égaux à leurs valeurs d'équilibre (indiquées par a0 et b0 sur la figure). Par conséquent, dans un graphe
sont les mêmes partout dans la météorite et sont égaux à leurs valeurs d'équilibre (indiquées par a0 et b0 sur la figure). Par conséquent, dans un graphe 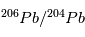 vs.
vs. 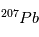 /
/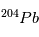 , toutes les mesures du rapport F doivent se situer une même droite, appelée isochrone, dont la pente va directement donner l’âge de la météorite (
, toutes les mesures du rapport F doivent se situer une même droite, appelée isochrone, dont la pente va directement donner l’âge de la météorite (
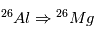 , dont le temps de ½ vie est de « seulement » 720 000ans. Notons que ni
, dont le temps de ½ vie est de « seulement » 720 000ans. Notons que ni 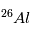 , ni
, ni 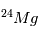 ne sont des isotopes naturels de leurs éléments, qui sont, respectivement,
ne sont des isotopes naturels de leurs éléments, qui sont, respectivement, 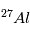 et
et 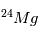 . A la différence de la désintégration d’
. A la différence de la désintégration d’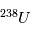 , il n’existe aujourd’hui plus de
, il n’existe aujourd’hui plus de 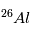 que l’on puisse mesurer. En principe, on a donc :
que l’on puisse mesurer. En principe, on a donc :
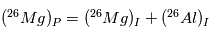
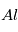 (tous isotopes confondus) différentes, mais que la proportion de
(tous isotopes confondus) différentes, mais que la proportion de 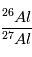 était, elle, la même, alors l’excès de
était, elle, la même, alors l’excès de 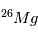 ne sera aujourd’hui pas partout le même, et cet excès sera relié à l’abondance actuelle locale de
ne sera aujourd’hui pas partout le même, et cet excès sera relié à l’abondance actuelle locale de 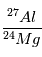 par la relation :
par la relation :
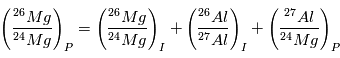
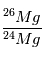 et
et 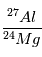 en différents endroits de la météorite
vont alors tracer une isochrone dont la pente donnera la teneur initiale en
en différents endroits de la météorite
vont alors tracer une isochrone dont la pente donnera la teneur initiale en
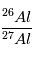 (
(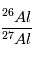 obtenus pour
différentes météorites, on peut obtenir une datation relative des temps de
formation de ces météorites. En effet, étant donné le temps de vie très court
de
obtenus pour
différentes météorites, on peut obtenir une datation relative des temps de
formation de ces météorites. En effet, étant donné le temps de vie très court
de 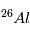 , sa teneur par rapport à
, sa teneur par rapport à 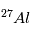 pourra être très différente suivant l’instant
où la météorite s’est formée. Si on compare les valeurs
pourra être très différente suivant l’instant
où la météorite s’est formée. Si on compare les valeurs 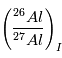 dans 2
météorites différentes, on obtient ainsi la datation relative de leur formation
par la formule:
dans 2
météorites différentes, on obtient ainsi la datation relative de leur formation
par la formule:
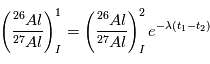
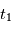 et
et 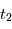 sont les instants de formation des 2 météorites, et
sont les instants de formation des 2 météorites, et 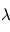 est le taux de
désintégration de la réaction
est le taux de
désintégration de la réaction 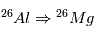
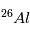 était uniformément
distribué dans la nébuleuse initiale. Les dernières recherches semblent cependant montrer que tel était bien le cas.
était uniformément
distribué dans la nébuleuse initiale. Les dernières recherches semblent cependant montrer que tel était bien le cas. 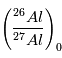 estimée correspond à ce qu’elle était au moment
de la dernière condensation de l’objet. En effet, quand le corps est dans un
état fluide (gaz, liquide), les abondances de
estimée correspond à ce qu’elle était au moment
de la dernière condensation de l’objet. En effet, quand le corps est dans un
état fluide (gaz, liquide), les abondances de 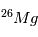 et
et 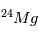 se ré-équilibrent
automatiquement à leurs proportions « naturelles » et tout excès antérieur
de
se ré-équilibrent
automatiquement à leurs proportions « naturelles » et tout excès antérieur
de 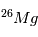 est effacé. Autrement dit, le chronomètre isotopique se « reset » lors
de tout épisode de très forte température.
est effacé. Autrement dit, le chronomètre isotopique se « reset » lors
de tout épisode de très forte température.